溶質 の 質量 求め 方
バイトクビ に なっ た溶質を求める. 水溶液全体は200g、その10%が溶質(食塩)となるので、 答えは20g になります。 <解法2>公式と方程式を使う 解法はこちら ※解答は半角数字の整数で入力してくださいね。 ①200gの水に50gの砂糖をとかしたときの濃度. 質量パーセント濃度. 質量パーセント濃度の求め方!「溶液」「溶質」「 …. 質量パーセント濃度(%)=溶質の質量÷(溶質の質量+溶媒の質量)×100 「溶液=溶質+溶媒」という基本的な式を代入することで公式を修正しただ …. 【5分でわかる】モル濃度と密度、質量パーセント濃度の考え方 . おまけです。質量モル濃度とは、溶質の物質量[mol]を溶 媒 の質量[kg]で割ったものです。 公式です。 $$質量モル濃度[mоl/kg] = frac{溶質の物質 …. 夫婦 の 花
あの 人 は 私 を 抱き たい 無料 占い3分でわかる!質量パーセント濃度の求め方の計算 …. 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 [%] )= (溶質の質量)÷(溶液の質量)×100. だ。 もうちょっと簡単に言ってあげると、 「溶かす物質の重さ」を「溶けてできた液体の重さ」で …. 濃度計算の公式・解き方(質量パーセント濃度・モ …. 溶液1Lに含まれる溶質のmolを モル濃度 という。 溶媒1kgに含まれる溶質のmolを 質量モル濃度 という。 溶液に含まれる溶質の割合を%で表したものを 質量パーセント濃度 という。. 溶液の質量パーセント濃度(w/w%)自動計算ツール|カガクな . 調製したい溶液の「濃度」と「質量」を入力して、計算ボタンを押してください。 溶液Aの方の濃度は0%より大きく、100%未満 …. モル濃度・質量パーセント濃度・質量モル濃度!濃 …. mathrm{ frac{溶質の質量[g]}{溶液の質量[g]}×100[%] } ] ②モル濃度 [mathrm{ frac{溶質の物質量[mol]}{溶液の体積[L]}[mol/L] } ] ③質量モル濃度 [mathrm{ frac{溶質の物質量[mol]}{溶媒の質量[kg]}[mol/kg] } ]. 濃度計算 溶質と溶媒の質量を入力し質量パーセント濃度を自動 . 溶質 (g)に食塩や砂糖等の質量を、溶媒 (g)に食塩や砂糖等を溶かす水等の質量を入力し計算ボタンを押してください。 小数点第二位で四捨五入して …. 【高校化学】「質量モル濃度」 | 映像授業のTry IT. 質量モル濃度を求めるのに必要なのは、 溶質の物質量 と 溶媒の質量 です。 それぞれを求めていきましょう。 溶質の物質量は、溶質の質量から求める. まずは、 溶質の物質量 から考えます。 今回は、水溶液の体積が与えられ …. モル濃度:質量パーセント濃度や密度、水和物での計算 - Hatsudy. 5 200 × 100 = 2.5. 質量パーセント濃度の単位はパーセント(%)です。 そのため、100をかける必要があります。 モル濃度(mol/L)は溶液(L)の …. モル濃度計算の解き方(公式・希釈時の濃度・密度や質量 . 溶質の物質量molを溶液の体積Lで割って得られる濃度を モル濃度 という。 モル濃度の単位は mol/L である。 [ mathrm {モル濃度 …. 水溶液の性質と質量パーセント濃度の計算‥「溶液」「溶質 . 溶液の質量は、 ポイント 溶液の質量 = 溶質の質量 + 溶媒の質量 となります。 溶かしたものと溶けたものの合計した重さのことで …. モル濃度と密度、質量パーセント濃度の考え方 | ViCOLLA . 質量パーセント濃度[%] = 溶質の質量[g] 溶液の質量[g] × 100 質 量 パ ー セ ン ト 濃 度 [ %] = 溶 質 の 質 量 [ g] 溶 液 の 質 量 [ g] × …. モル濃度とは?計算・求め方・公式はコレで完璧!質量 . 【目次】 1:モル濃度とは? 質量パーセントとの違いもわかる! 2:モル濃度の計算方法・求め方(公式)と単位. 3:モル濃度か …. 【高校化学基礎】「質量パーセント濃度とは」 | 映像授業のTry . 質量パーセント濃度 をどのように求めるかというと、次の式に当てはめます。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g …. 中1理科「質量パーセント濃度の求め方」 | 中学生の無料勉強 . シリンダー シール 交換 の やり方
指 脱臼 自分 で 治す溶媒と溶質を合わせた溶液の質量を求める( (水)溶液全体の重さを求めます。 溶質÷ (水)溶液で溶質占める割合を計算する(分数式 …. 物質量(mol)の求め方とは?モル計算の基本を解説!|高校生 . 1.物質量 (mol)とはいったいなにか? 2.物質量 (mol)の計算をしよう. 2-1.1molあたりの重さ. 2-2.1molあたりの体積. 2-3.1molあたりの …. 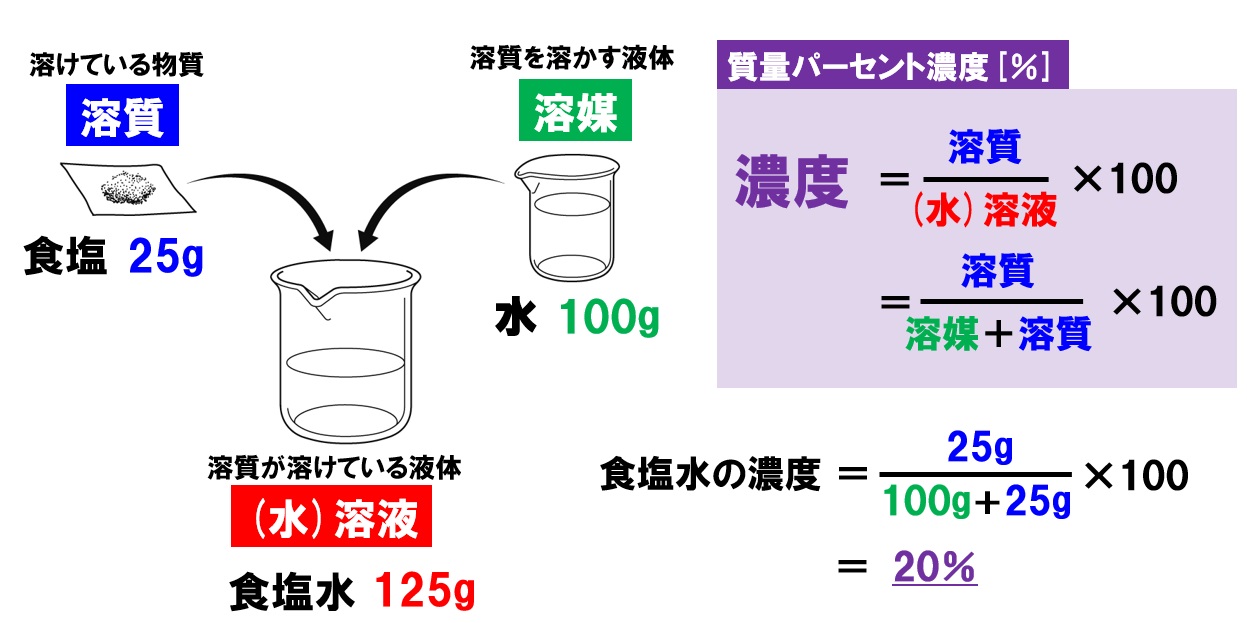
我々 だ 小説 シャオロンモル濃度に体積を掛けると直ちに物質量が …. 質量パーセント濃度や溶質や溶媒を求めるときの式を教えて . 溶質の質量は、溶液の質量×質量パーセント濃度÷100. 溶媒の質量=溶液の質量× (溶液の質量-質量パーセント濃度÷100) ちょっと難しいけど… (´ …. 溶解度の計算問題は求め方と計算式の作り方が簡単. 化学基礎. 計算問題. Tweet. 溶解度は水100gに溶質が何g解けるか? という単純なものです。 計算問題も溶媒、溶質、溶液が全 …. 溶解度とは(溶解度曲線と公式) | 理系ラボ. 1. 溶解平衡. 1.1 飽和溶液. 一定量の液体(溶媒)に、固体(溶質)を少しずつ溶かしていくと、あるところから溶けきれずに固体が残るようになりま …. 溶解度とは(溶解度曲線と公式) | 理系ラボ. 1. 溶解平衡 1.1 飽和溶液 一定量の液体(溶媒)に、固体(溶質)を少しずつ溶かしていくと、あるところから溶けきれずに固体が残るようになります。 すなわち、ある一定温度のもとでは、一定量の液体に溶解する固体の量にはある一定の限度があります。. 溶液の質量パーセント濃度の求め方と比重を利用した …. 溶液の質量パーセント濃度やモル濃度についてはすでに説明してありますのでここでは比重も含めた計算問題と求め方を紹介します。濃度の定義についてはそれほど難しさは感じないと思いますが問題は計算ですね。何故難しく感じるかというと …. これで理科マスター!質量パーセント濃度を計算する5つの問題 . 質量パーセント濃度を計算する問題を出してほしい! こんにちは!この記事を書いてるKenだよ。握りたいね。 中1の理科では、 質量パーセント濃度の求め方の公式 を勉強したよね?? 「公式は覚えられそうだけど、テスト本番で忘れそう・・・」. 「質量パーセント濃度」の求め方は? ⇒ 楽勝! | 中1生の . 中1です。「濃度」の求め方が分かりません…。 中学生から、こんなご質問をいただきました。 「 質量パーセント濃度 が苦手です…。 “溶質・溶媒・溶液”と関係ありますか?」 大丈夫、安心してください。 質量パーセント濃度の求め方には、. 水溶液の濃度(質量パーセント濃度)の公式と求め方:食塩水 . 水溶液の濃さは溶質の質量を水溶液の質量で割って 100 をかけて求めます。 濃度(%)=溶質の重さ(g)÷水溶液の重さ(g)×100 この値を質量パーセント濃度ともいいます。単に濃さという場合は、この質量パーセント濃度を指します. 水溶液の濃度 ~濃度の正しい求め方や問題のパターンを知ると . 理科. 水溶液の濃度 ~濃度の正しい求め方や問題のパターンを知るとともに,少数の計算力を身につけよう~. 水溶液の性質を調べたり,水溶液に関する問題を解くうえで,その濃度を正確に知ることはとても重要なことになってきます. 特に学び始 …. 中1化学【水溶液・濃度】 | 中学理科 ポイントまとめと整理. 質量パーセント濃度 単に濃度ということも多い。以下のように求められる。$$質量パーセント濃度(%)=frac{溶質(g)}{水溶液全体(g)}×100$$ また次の式で溶質の量を求められることも覚えておきましょう。$$溶質=水溶液全体×frac{濃度}{100}$$. 溶液中の溶質の濃度を示す「質量百分率濃度」を元研究員が . 質量百分率濃度って知っているか? 難しい言葉で表しているが、小学校や中学校の理科で習う「質量パーセント濃度」とほぼ同じです。試験で問われることも多いよな。 今回は「なぜ濃度が重要なのか」から「質量パーセント濃度の公式」と「問題の解き方」について、化学実験を生業にして . 物質量molを質量、体積に変換できますか? | ジグザグ科学.com. 本記事は、物質量を質量や体積に換算する方法に焦点を当てた記事です。具体的には物質量から質量(g)、体積(L)の求め方について解説しています。本記事を理解すると、物質量の扱い方に関して、理解が深まります。また、物質量から他の単位への換算が容易にできるようになります。. 中1理科「質量パーセント濃度の求め方」 | 中学生の無料勉強 . 中1理科「質量パーセント濃度の求め方」です。 質量パーセント濃度のポイント 質量パーセント濃度は水溶液にふくまれている溶質の質量の割合を表します。 <用語の確認> 溶質…溶けている物質のこと 溶媒…溶質を溶かす液体のこと (水)溶 …. 濃度計算 溶質と溶媒の質量を入力し質量パーセント濃度を自動 . 質量パーセント濃度 (%) = ( 溶質の質量 (g) ÷ 溶液の質量 (g) ) × 100. で質量パーセント濃度を算出することができます。. 食塩30g を 水120g に溶かして 食塩水150g を作ると、. 水に溶ける 食塩30g が 溶質 、食塩を溶かす 水120g が 溶媒 、混ぜて出来た 食塩水150g …. 【中1・理科】飽和水溶液・濃度・溶解度の重要ポイント |札幌 . 質量パーセント濃度 ・・・溶液全体のうち、どのくらいの割合で溶質が溶けているのか. 飽和水溶液 ・・・飽和に達した水溶液. 飽和 ・・・もうそれ以上、溶質が溶けなくなった状態. 溶解度 ・・・ある温度で 水100g にとける溶質の質量. 溶解度を …. wt%、vol%、mol%の意味と計算例 - 具体例で学ぶ数学. wt%とは「重さで考えたときの濃度」 vol%とは「体積で考えたときの濃度」 mol%とは「物質量(モル)で考 ウェイトパーセントは、 溶質(溶かしている物質)の重さ $div$ 全体の重さ で計算できます。 例えば、5グラムの食塩と95グラムの水を混ぜて、100グラムの食塩水を作ったときのwt%は、. ラウールの法則と蒸気圧降下 | 化学のグルメ. ラウールの法則 ある温度における純溶媒の蒸気圧をP 0 とし、同じ溶媒に不揮発性の溶質粒子を溶解させた溶液(溶媒+溶質)の蒸気圧をPとする。 純溶媒と比較して、溶液表面から蒸発する溶媒分子の数は(溶質粒子が邪魔になるため)減少し、P 0 >Pとなる。. 質量パーセント濃度のしきで、なぜ溶質100gあたりに溶けている . 質量パーセント濃度 [%]のこの問題がどうしても解けません。. ↓ (例)水100gに塩10gを溶かした水溶液の質量パーセント濃度は…. 【公式】質量パーセント濃度 [%]=溶質の質量 [g]/溶液の質量 [g]×10 0 私の計算だとどうしても割りきれないです。. ネットで調べ . 質量パーセント濃度の求め方!「溶液」「溶質」「溶媒」の . 【問題3】 質量パーセント濃度8%の食塩水を300g作るには、水何g、食塩何gが必要でしょうか。 解法のポイント 問題をパターン化することも大切ですが、公式に対するしっかりとした理解と、溶質・溶媒・溶液に注目するという視点が確立していれば、この問題のように別の角度から問われたとし . モル濃度を計算する 4つの方法 - wikiHow. モル濃度は溶質の物質量と溶液の体積との関係を表します。物質量(mol)と体積(L)、質量(g)と体積(L)、または物質量(mol)と体積(ml)がわかればモル濃度の値を求めることができます。2つの変数を公式に当てはめて計算すると正しいモル濃度の値を導くことができます。 モル濃度を . 【高校化学基礎】「質量パーセント濃度とは」 | 映像授業のTry . 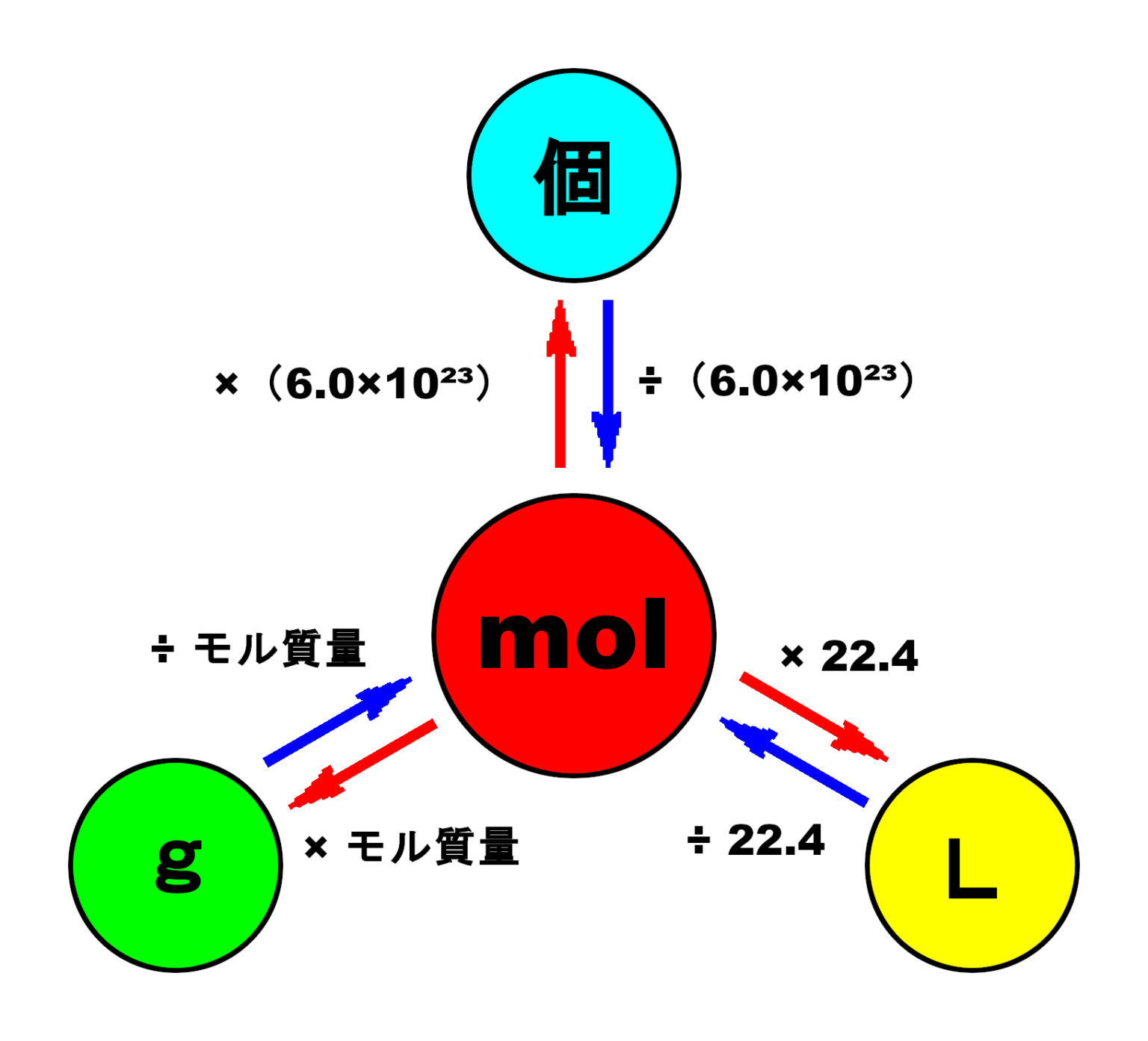
ドラゴンボール ヒーローズ cp とは一般に,溶液中に含まれる溶質の割合を濃度といい,その表し方には,質量パーセント濃度 . 中学1年生 理科 【水溶液の性質】 練習問題プリント 無料 . 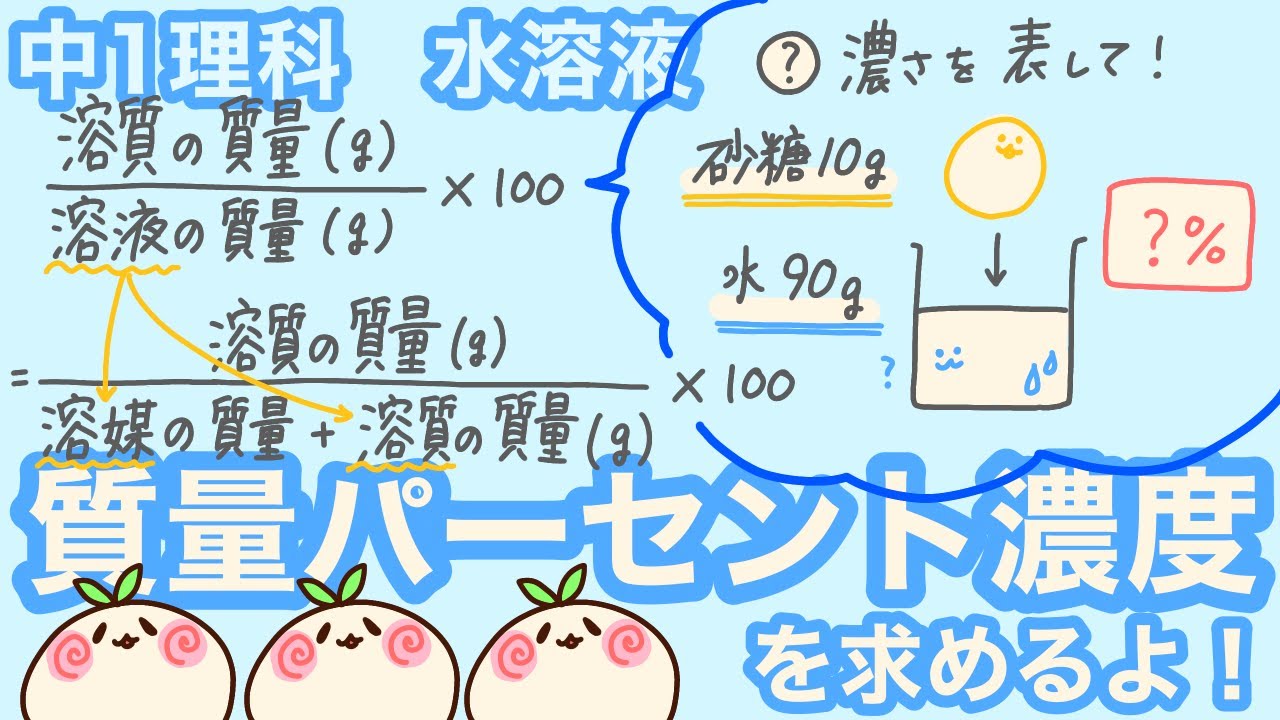
pdf を url に するモル濃度:質量パーセント濃度や密度、水和物での計算 - Hatsudy. 質量パーセント濃度に対して溶液の重さ(g)をかけると、当然ながら溶質の重さ(g)を計算できます。 注意点として、 質量パーセント濃度では単位がパーセントであるため、100で割る必要があります。. 化学講座 第12回:濃度と密度 | 私立・国公立大学医学部に . この式を見ると、質量パーセント濃度を求めるためには、溶質の質量と、溶液の質量が分かれば良いことがわかります。 与えられた条件から溶質の質量と、溶液の質量が求まらないか考えてみますが、どちらもこの溶液の量が分からないと求めようがなさそうです。. 「溶質」「溶媒」「溶液」の違いは? ⇒ 見分けるコツ! | 中1 . 中1です。「溶質」「溶媒」「溶液」の違いは…? 中学生から、こんなご質問が届きました。 「物質のとけ方の話です。 “溶質・溶媒・溶液”の違い が分かりません…」 なるほど、 “溶”の字 が共通で、 ちょっと困ったのですね。 でも大丈夫、安心してください。. 溶解度と温度変化による結晶析出量の計算方法と求め方. これらの等式は「 質量保存の法則 」を示しています。. つまり溶解度の温度変化における析出量に関する原理は「質量保存の法則」だということです。. (溶質の総質量)=(温度変化後の溶質の質量)+(析出した溶質の質量). この関係を利用し …. wbc ワイセ
痩せ て いる の に 脂肪 肝中1理科「水溶液」これで溶解度曲線と再結晶の2つの方法が . 中1理科の「水溶液と再結晶」について詳しく説明しています。①「溶質・溶媒・溶液」②「溶解度」③「再結晶」について、それぞれ要点をわかりやすくまとめています。再結晶の2通りの方法については、特に詳しく解説しています。. 【モル計算】単位を駆使!物質量molが絡む問題の解法(原子 . はじめに 【プロ講師解説】このページでは『【モル計算】単位を駆使!物質量molが絡む問題の解法(原子量・体積・アボガドロ数など)』について解説しています。 これと同様の考え方で、粒子(原子・分子など)を6.0×10 23 個集めたカタマリを…1″mol”という。. これで理科マスター!質量パーセント濃度を計算する5つの問題 . Ken これで理科マスター!質量パーセント濃度を計算する5つの問題 質量パーセント濃度を計算する問題を出してほしい! こんにちは!この記事を書いてるKenだよ。握りたいね。 中1の理科では、 質量パーセント濃度の求め方の. 加藤 胃腸 科 内科 とび しま こども クリニック
ドラッグ ストア で 買える 精力 剤沸点上昇と凝固点降下を求める公式と質量モル濃度の …. 混合物では全ての溶質や粒子が沸点上昇に影響するので、求めたい物質とそれ以外の物質も含めた状態で方程式に組み込む必要があります。 次からは状態が2つある場合です。 考え方のよっては簡単になる問題もありますが、あえて . 【高校理論化学】溶液の濃度と調製(質量パーセント濃度 . 定期試験・大学入試に特化した問題・解説、暗記事項まとめ。定義・原理・単位を理解していなければ応用が利かない。 溶液の濃度と調製(質量パーセント濃度・密度とモル濃度の単位換算) 溶解 溶質(固体・液体・気体)が溶媒(液体)中に拡散して均一液体(溶液)になる現象. 溶媒1kgの中に溶質が何mol溶けているかを示す「質 …. 理科の授業で「食塩何グラムを水何グラムに溶かしました。濃度を計算して求めましょう。」という問題を解いたことがありませんか?この濃度というのが質量パーセント濃度です。 質量パーセント濃度(%)= 溶質の質量(g)÷ 溶液(溶質+溶媒)の質量(g)× 100. 【中1理科】溶解度・溶解度曲線とは ~計算問題の解き方 . 映像授業による解説 動画はこちら 3. 溶解度とは 物質を水に溶かすとき、溶ける量には限界があります。 その量を数字で表すのが、 溶解度 という考え方です。 そして、中学理科では、このときの水の質量が100gと決まっています。 つまり、溶解度とは、 100gの水に溶ける物質の質量 なのです。. 【中1理科】3分でわかる!溶質・溶媒・溶液・水溶液の違いとは . 溶質・溶媒・溶液・水溶液の違いをわかりやすく解説してみました。よかったら参考にしてください。 人気記事 【カンタン公式】扇形の中心角の求め方がわかる3つのステップ 直径から計算!「円周の長さの求め方」の公式を3秒で覚える方法. 飽和水溶液中の物質の質量を求める式は飽和水溶液の質量× . 高校化学(質量パーセント濃度) 実験で、水酸化ナトリウム水溶液で中和滴定して食酢の濃度を調べ、その結果から、 「食酢の密度を1.00g/ とし、食酢中の酢酸の質量パーセント濃度を求めよ」 という問題なのですが、解き方を教えて. 溶液の濃度表示(単位) | 薬学マン. 溶液の濃度表示について 質量百分率 % 溶液100g中の溶質の質量(g) 1% = 1g / 100g 体積百分率 vol% 溶液100mL中の溶質の容量(mL) 1 vol% = 1 mL / 100 mL 質量対容量百分率 w/v% 溶液100mL中の溶質の質量(g) 1 w/% = 1g / 100mL モル濃度 mol/L 溶液1L中に含まれる溶質の物質量(mol) 1. 【固体の溶解度】水を蒸発させ溶質の析出量を求める問題の . 固体の溶解度の問題で水を蒸発させて溶質がどれだけ析出するのかを求める問題の解法をご紹介します。固体の溶解度の問題では、水だけを蒸発させる問題があり、このパターンの問題を覚えるべきだという人もいるんですが、全くその必要はありません。固体の溶解度の分野はたった1つの . 第3章 物質と溶液の組成 | 化学 第2版. 式量 この教科書の前の章では、原子質量単位の発展、平均原子質量の概念、物質の元素構成を表すための化学式の使用について説明しました。これらの考え方を拡張して、物質の式で表されるすべての原子の平均原子質量を合計することによって、物質の式量を計算することができます。. 溶解度積とは(沈殿の計算・求め方・単位) - 理系ラボ. 溶解度積とは(沈殿の計算・求め方・単位). 東大塾長の山田です。. このページでは溶解度積について解説しています。. 例題を使って詳しく説明しています。. 是非参考にしてください。. 1. 溶解平衡. (NaCl)の固体と(NaCl)の飽和水溶液が共存しているとき . 【高校化学基礎】「密度とモル濃度」 | 映像授業のTry IT (トライ . しかし、今求めたいのは、水に溶けている水酸化ナトリウムのモル濃度です。 必要なのは水酸化ナトリウムの質量であり、水は邪魔ですよね。 ですから、水溶液全体1200gのうち、 溶質の質量 はいくらか求めましょう。. |溶液の濃度とその表し方 g,. 1 溶液の濃度とその表し方 598.08g/mol 1,803g =18.38mol この物質量のH2SO4が1Lに含まれているので硫酸の容量モル濃度は18.4mol/L。 ② 酢酸1Lの重さは1,050gで,100%酢酸中の酢酸の質量は 1,050g 100 100 ×. 質量/体積(容積)パーセント濃度の求め方 - plala.or.jp. 質量/体積(容積)パーセント濃度の求め方. 溶質の質量 (g) ÷ 溶液の体積・容積 (ml) × 100 = 質量/体積パーセント濃度 %. 体積(容積)ml にしめる、溶質の割合を求める方法です。. 質量パーセント濃度は、溶液 100g に占める溶質の割合を求める方法ですが . 水溶液と質量パーセント濃度の計算問題 | hiromaru-note. 水85gに塩化ナトリウムを15g溶かした.水溶液の質量パーセント濃度は何%か. 水は溶媒で85g,塩化ナトリウムは溶質で15g.. これらを合わせると,塩化ナトリウム水溶液100gできます.. したがって,. 濃度 = 溶質 ÷ 溶液 ×100 = 15g ÷ 100g ×100 = 15%. となります.. 濃度の計算が苦手な人必見!公式と練習問題を元製薬会社研究 . 質量パーセント濃度 (%)= 溶質の質量(g)÷ 溶液(溶質+溶媒)の質量(g)× 100. なので、20 (g) ÷ 400 (g) × 100. 
陶器 に 書ける ペン結晶の析出量の求め方がわからない…計算方法を解説!|化学 . 結晶の析出量は,質量の値がいろいろと出てきて複雑に感じます。. しかし,溶液,溶質,溶媒の質量を区別. し,析出量に関する比例式を立てることができれば,あとは計算を実行するだけとなります。. その計算も,多. くの場合整数で求められ …. 【中1理科】質量パーセント濃度の求め方 | Examee. 濃度の計算方法. 濃度の計算方法は、次の手順で行います。. 溶媒と溶質を合わせた溶液の質量を求める. まずは、溶液全体の重さを求めます。. 溶質÷溶液で溶質の占める割合を計算する. 分数式で表すと分子が溶質、分母が溶液の質量です。. 最後 …. 溶液の濃度とその表し方 - 国立大学法人信州大学. 溶液の濃度とその表し方 1.原子量と分子量 定義・説明 原子量は質量数12の炭素同位体( )の質量を12とした時の、他の元素の相対的質量である。 したがって、原子量は無次元で単位はない。 分子量はその分子を構成している原子量の和と . 中学理科【計算問題】「質量パーセント濃度の計算」 - YouTube. 『中学理科・計算問題』の解説動画をまとめた再生リストは、コチラからご覧下さい⇒ ww.youtube.com/playlist?list . 化学の質量パーセント濃度について - 二種類の溶質が入った . 1 回答. 化学の質量パーセント濃度について 二種類の溶質が入った溶液の質量パーセント濃度の計算方法がわかりません。. 新生児 へその緒 取れ ない
開い た 毛穴 戻ら ない例えば、水30gに砂糖10gが完全に溶けきった溶液の質量パーセント濃度は、 10÷ (30+10)×100=25% と計算できるのはわかるのですが、 水30gに . 【物理化学】凝固点降下と沸点上昇の原理をわかりやすく解説 . 理系の筆者が化学系の用語や論文、動画、ノウハウなどを紹介する化学ブログ 凝固点降下 溶質が溶媒に溶けて、溶液の凝固点が降下する現象を凝固点降下という。希薄な溶液の凝固点降下度 (K)は溶媒固有のモル凝固点降下定数 (K/質量モル濃度)と質量モル濃度 (mol/溶媒1 kg)の積である。. 3分で簡単「モル濃度」!溶液1L中に溶質が何モル溶けている . 部屋 を 区切る 方法
質量モル濃度は溶媒1キログラム中(分母は溶媒なので注意が必要です)に溶けている溶質の物質量(mol)を表した濃度になります。計算式は 質量モル濃度(mol/kg)= 溶質の物質量(mol)÷ 溶媒の体積(kg) です。. 浸透圧(公式・単位・計算問題・求め方・ファントホッフの . はじめに 【プロ講師解説】このページでは『浸透圧(公式・単位・計算問題・求め方・ファントホッフの法則)』について解説しています。 半透膜とは 小さい物質だけを通し大きい物質は通さない膜を半透膜という。 浸透圧の単元では基本的に半 ….